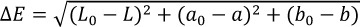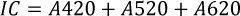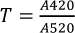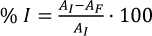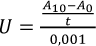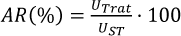| Issue |
BIO Web Conf.
Volume 68, 2023
44th World Congress of Vine and Wine
|
|
|---|---|---|
| Article Number | 02023 | |
| Number of page(s) | 8 | |
| Section | Oenology | |
| DOI | https://doi.org/10.1051/bioconf/20236802023 | |
| Published online | 06 December 2023 | |
Stabilization of white grape must by application of supercritical CO2 as a strategy to reduce the SO2 content
Chemical Engineering and Food Technology Department, Wine and Agrifood Research Institute (IVAGRO), University of Cadiz, Puerto Real, 11519 Cadiz, Spain
Winemaking worldwide, and especially the one carried out in warm climates, is looking for strategies to prevent enzymatic and microbial alterations of must and wines alternative to SO2 addition. However, there is any methodology as efficient as SO2, being used in combination with those substances in the best of cases, which does not suppose a real solution to the problem. In search of safer alternatives to preserve enological products, high-pressure treatments using supercritical CO2 can be a sustainable alternative The aim of this study is to analyze the biocidal effect, and enzymatic inactivation of supercritical CO2 on white grape must (Pedro Ximenez variety), in order to reduce SO2 in the pre-fermentative stage. It was processed by varying the main variable of the process, the percentage of CO2 (10, 40, and 70%), keeping the rest of the variables constant (100 bar, 35 ºC 10 min). Results are very promising and any of the treatment conditions seem to alter the physicochemical characteristics of must. Regarding must stabilization, this technique has proven to be very efficient in the reduction of total microorganisms, as well as reduce enzymatic activity of polyphenol oxidase, showing better results than those obtain when using SO2.
© The Authors, published by EDP Sciences, 2023
 This is an Open Access article distributed under the terms of the Creative Commons Attribution License 4.0, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
This is an Open Access article distributed under the terms of the Creative Commons Attribution License 4.0, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
1 Introducción
Desde el comienzo de su procesamiento, el mosto de uva sufre alteraciones, ya que es muy sensible a la acción microbiana y enzimática. Contiene polifenol oxidasas (PPO) que modifican su color, produciendo su pardeamiento, y su turbidez, afectando a sus características organolépticas [1]. Como resultado, puede disminuir significativamente su aceptación por parte del consumidor, su vida de almacenamiento y, por tanto, puede verse reducido su valor.
En la industria enológica es muy habitual el empleo de sulfuroso (SO2), por sus propiedades antioxidantes, antioxidasicas y antimicrobianas sobre el mosto y el vino [2]. Especialmente en vinos blancos por su alta sensibilidad, el SO2 se añade tras el estrujado y antes de la fermentación, con el objetivo de producir vinos con mejores características sensoriales y aromas más finos, así como en el embotellado, para garantizar su protección a lo largo del almacenamiento [3]. Sin embargo, en los últimos años, su empleo en la industria alimentaria ha suscitado mucha preocupación sobre la seguridad de los consumidores, ya que puede producir diferentes efectos adversos en personas sensibles, lo que implica su obligatoriedad en el etiquetado [4]. Aunque actualmente no existe ninguna sustancia química que pueda sustituir al 100 % el uso de sulfuroso, se están estudiando sustancias alternativas o tecnologías innovadoras que permitan reducir o eliminar su cantidad, reduciendo su uso en el embotellado donde, a dosis muy bajas, se consigue una prolongación de la vida útil del producto [5]. Algunas sustancias alternativas al sulfuroso que han sido utilizadas son el dicarbonato de dimetilo, y las lisozimas, con efecto antimicrobiano, y el glutatión, que es un antioxidante, protegiendo al vino fundamentalmente de su oxidación [6]. En cuanto a los tratamientos físicos, en la actualidad está permitida por la OIV la flash pasteurización del vino, que es un tratamiento térmico que destruye las formas vegetativas de los microorganismos mediante la aplicación de calor [7]. Sin embargo, los tratamientos térmicos afectan negativamente a la calidad nutricional y presentan un impacto negativo sobre sus características organolépticas [8]. Por este motivo, los tratamientos físicos no térmicos están siendo el foco de estudio en los últimos años [9]. De hecho, en el año 2020 la OIV aprobó como práctica enológica el empleo de altas presiones hidrostáticas como tratamiento para el control microbiológico en mostos (OIV-OENO 594B-2020). Del mismo modo, la tecnología de alta presión con fluidos supercríticos, concretamente empleando CO2, ha presentado un gran potencial para la estabilización de zumos de frutas como kiwi, melocotón, uva, naranja, manzana, etc, obteniendo resultados prometedores [10, 11,12, 13]. Ha resultado ser muy eficaz en la inactivación de microorganismos y enzimas empleando condiciones suaves de temperatura, sin modificar sus cualidades fisicoquímicas y organolépticas [14]. Además, esta tecnología ofrece una atmósfera inerte beneficiosa para el control de la oxidación y mostos libres de residuos tras el tratamiento, por lo que es una alternativa a otros tratamientos físicos como ultrasonidos [15] y campos eléctricos pulsantes, bajo estudio para ese mismo fin [16].
El objetivo de este trabajo consiste en estudiar la efectividad del tratamiento con CO2 supercrítico en la estabilización de mosto de uva blanca, modificando el porcentaje de CO2 (10, 40 y 70%), y manteniendo constantes el resto de variables (100 bar, 35 ºC y 10 min). Se evaluó su influencia sobre diferentes parámetros convencionales de caracterización de mostos, como son el pH, acidez, color, densidad, contenido fenólico y capacidad antioxidante de los mostos tratados, así como su efectividad antimicrobiana y antioxidásica.
2 Material y métodos
2.1 Preparación del mosto
Se utilizó uva de la variedad Pedro Ximénez (12.8 % vol. alcohol probable), suministrada por la bodega Forlong (El Puerto de Santa María, España), que se conservó a -13 ºC hasta su uso. Las uvas se descongelaron 24 h previas al prensado en una cámara a 4 ºC. Una vez descongelados los racimos, fueron seleccionados y despalillados de forma manual, obteniendo aproximadamente 9 kg de uvas despalilladas. Para facilitar el prensado, se realizó un molturado manual. Las uvas molturadas fueron prensadas en una prensa vertical de laboratorio. Se obtuvieron 5.5 L de mosto yema, que fueron distribuidos por igual en dos depósitos de metacrilato. En el momento del desfangado, se añadió la enzima Enovin Clar (Agrovin, España) en una dosis de 1.5 g/hL, previamente disuelta en agua siguiendo las indicaciones del fabricante. Para evitar oxidaciones, los depósitos se cubrieron con papel de aluminio y se introdujeron en una cámara de frío a 4 ºC en oscuridad durante 48 h. El mosto limpio se conservó a -13 ºC hasta su posterior uso.
2.2 Tratamiento con CO2 supercrítico
El tratamiento con CO2 supercrítico (scCO2) se realizó en un equipo de la marca Thar Technologies (Pittsburgh, EE.UU., modelo SF100), que consta de un reactor de acero inoxidable de 104 mL provisto de una doble camisa, una bomba P50 de alta presión, un precalentador, y una reguladora de presión posterior (BPR), que permite controlar la presión del sistema (Fig. 1). Para el control de la temperatura durante el proceso, se utilizaron tres termopares que se localizaban dentro y fuera del reactor y en el precalentador.
Para el tratamiento, en el reactor previamente desinfectado con etanol, se introdujo el volumen de mosto necesario, según el porcentaje de CO2 a utilizar (10, 40 y 70% respecto al volumen total del reactor). A continuación, se cerró herméticamente el reactor y se bombeó CO2 al flujo establecido (10 g/min) hasta alcanzar la presión deseada. Los experimentos se llevaron a cabo en modo discontinuo a 100 bar y 35 ºC durante 10 min. Una vez finalizado el tratamiento, se procedió a una despresurización lenta para favorecer la salida paulatina del CO2. El mosto se recogió del reactor en condiciones de esterilidad, y se conservó a -20 ºC en tubos estériles de 50 mL hasta su posterior uso.
 |
Figura 1 Diagrama de la planta de tratamiento con scCO2 supercrítico. |
2.3 Caracterización del mosto
Se evaluó el efecto del tratamiento con scCO2 sobre diferentes parámetros físico-químicos del mosto.
2.3.1 pH y acidez
Se midió el pH de los mostos tratados en un pHmetro pH Basic 20 (Crison, España).
La acidez total de los mostos se determinó mediante una valoración ácido-base con una disolución 0,1 M de NaOH estandarizada con ftalato ácido de potasio. Se expresó la acidez en concentración de ácido tartárico. Cada determinación se realizó por duplicado.
2.3.2 Densidad
La densidad de los mostos se determinó en un densímetro electrónico DMA 5000 M de Anton Paar (Graz, Austria). Cada medición se realizó por triplicado a una temperatura de 20 ºC.
2.3.3 Color
Se empleó el software MSCV (Método Simplificado para el Color de los Vinos) (https://www.unirioja.es/color/ descargas.shtml), desarrollado por el Departamento de Química de la Universidad de la Rioja (España), que permite calcular las coordenadas de color en el espacio CIELAB empleando únicamente los valores de absorbancia de 450, 520, 570 y 630 nm, de las muestras filtradas. Estas absorbancias fueron medidas en un espectrofotómetro UV-VIS Cary 60 UV-Vis (Agilent Technologies, Santa Clara, EE.UU.). A partir de estos parámetros, se calculó el ∆E, siguiendo la ecuación 1, para determinar diferencias visuales entre las muestras tratadas entre sí, así como entre estas y el mosto sin tratar.
Para la determinación de la intensidad colorante (IC) y la tonalidad (T) se midió la absorbancia a 420, 520 y 620 nm, empleando las ecuaciones 2 y 3.
2.3.4 Índice de polifenoles totales (IPT)
El índice de polifenoles totales de los mostos se determinó mediante la medida de absorbancia a 280 nm en una cubeta de cuarzo utilizando un espectrofotómetro UV-VIS Cary 60 UV-Vis (Agilent Technologies, Santa Clara, EE.UU). Previamente, las muestras fueron filtradas a través de un filtro de nylon de 0,45 mm y diluidas con agua destilada en una proporción 1:10. Cada determinación se realizó en duplicado.
2.3.5 Capacidad antioxidante
La capacidad antioxidante de los mostos se determinó utilizando el método del DPPH ajustado a microplacas de 96 pocillos descrito por Cejudo et al. [17] . En cada pocillo se añadían 7 µL de muestra y 293 µL de la disolución de DPPH (6·10-5 M) preparada en etanol. Tras 3 horas de incubación a temperatura ambiente y en oscuridad, se medía la absorbancia a 515 nm utilizando un lector de microplacas BioTek Synergy HTX multi-mode reader (Agilent Technologies, Santa Clara, EE.UU.). Cada análisis se realizó por duplicado.
La actividad antioxidante de los mostos se expresó como porcentaje de inhibición (% I) utilizando la ecuación 4, siendo AI y AF la absorbancia a tiempo inicial y tras la incubación, respectivamente.
2.3.6 Actividad polifenol oxidasa
La actividad de la enzima polifenol oxidasa (PPO) presente en los mostos se determinó utilizando el método de Loira et al. [18] con ligeras modificaciones. En tubos de ensayo se añadían 150 µL de muestra y 3 mL de una disolución de catecol 0.07 M y tampón fosfato sódico 0.05 M a pH 6. Se midió la absorbancia a 420 nm en un espectrofotómetro UV-VIS Cary 60 UV-Vis (Agilent Technologies, Santa Clara, EE.UU.) a tiempo cero y tras diez minutos de reacción. Cada determinación se realizó por triplicado.
Los resultados se expresaron como unidades de actividad enzimática (U) y como porcentaje de actividad residual (AR). Una unidad enzimática se definió como la cantidad de enzima que aumenta la absorbancia en 0.001 unidades por minuto a 420 nm. La actividad enzimática se definió según la ecuación 4, siendo A0 y A10, las absorbancias a tiempo cero y tras 10 min de reacción, respectivamente, y t el tiempo de incubación (10 minutos).
La actividad enzimática residual se calculó utilizando la ecuación 5, siendo UTrat las unidades de actividad de los mostros tratados y UST las unidades de actividad del mosto sin tratar.
2.3.7 Inactivación microbiológica
Se realizó un análisis microbiológico tanto del mosto sin tratar como de los mostos tratados para evaluar la eficacia del tratamiento con fluidos supercríticos. Para determinar la concentración de microorganismos aerobios totales se prepararon placas Petri con medio PCA (Plate Count Agar) compuesto por triptona (4.5 g/L), extracto de levadura (2.25 g/L), glucosa (0.90 g/L) y agar (13.5 g/L). Para el recuento de las colonias de levaduras, se prepararon placas con medio YPD (Yeast extract Peptone Dextrose) compuesto por extracto de levadura (1%), peptona bacteriológica (2%), glucosa (2%), agar (2%) y el antibiótico cloranfenicol (100 mg/L). Para el recuento de las bacterias lácticas, se prepararon placas con medio MRS (De Man, Rogosa y Sharpe) compuesto por hidrolizado de caseína (10 g/L), extracto de carne (10 g/L), extracto de levadura (10 g/L), glucosa (20 g/L), hidrogeno fosfato de dipotasio (2 g/L), acetato de sodio (5 g/L), citrato de diamonio (2 g/L), sulfato de magnesio (0.20 g/L), sulfato de manganeso (0.05 g/L) y Tween 80 (1.08 g/L). Cada medio se sembró con 100 µL de los diferentes mostos sin diluir, realizando cada experimento en triplicado. Las placas se incubaron a 30 ºC durante 48 h, tiempo tras el cual se determinaron las unidades formadoras de colonias por mililitro (UFC/mL).
2.4 Análisis estadístico
Para evaluar la presencia de diferencias significativas entre los tratamientos, se realizó un ANOVA Simple según el análisis LSD (Least Squared Differences – Mínimas diferencias significativas) a un p-valor < 0.05. Para ello se utilizó el software Statgraphics Centurion 18 (Statgraphics Technologies, The Plains, EE.UU.).
3 Resultados y Discusión
3.1 Caracterización de los mostos
3.1.1 Acidez y pH
Los valores de acidez y pH de los mostos tras el tratamiento con CO2 supercrítico pueden sufrir modificaciones, ya que éste puede hacer descender el pH al disolverse en el medio acuoso formando H2CO3, que a su vez se disocia en HCO3-, CO32- y H+ [19]. Como se observa en la Tabla 1, no se observaron diferencias significativas a un p < 0.05 en el valor del pH de los distintos mostos. Estos resultados concuerdan con los obtenidos por Fabroni et al., [12], que no encontraron diferencias significativas en el valor del pH entre el zumo de naranja control y el tratado a 130 bar, 36 ºC y 28% de CO2. Al igual ocurría en el trabajo de Briongos et al. [20], en que se trató zumo de naranja variando la presión de 100 a 300 bar, en un rango de temperaturas de 2 a 40 ºC, y tiempos de 3 hasta 60 min. En este último trabajo se justifica con el bajo pH del zumo de naranja que podría estar dificultando la disociación del ácido carbónico, lo cual es extrapolable al mosto del presente estudio, que presenta pH similares.
Sin embargo, no se observan diferencias significativas entre la acidez de las muestras tratadas y el control, aunque sí entre la muestra tratada al 10% y las tratadas al 40y 70%. Cuando se trató zumo de uva a presiones entre 140y 180 bar, 35 ºC y 36.50% CO2 durante 10 min, tampoco se observaron cambios significativos ni en el pH ni en la acidez [11]. Otros autores han encontrado el efecto opuesto. Así, por ejemplo, Guo et al. [21] reportaron un leve aumento de los ácidos málico y tartárico tras el tratamiento del zumo del lichi a 80 bar, 36 ºC y 90% de CO2 durante 2 min. Sin embargo, a pesar de obtener un aumento de acidez en los mostos tratados, las diferencias no fueron estadísticamente significativas.
Valores de pH, acidez y densidad del mosto sin tratar y tras la aplicación del tratamiento. Letras diferentes en la misma columna denotan diferencias significativas según la prueba de LSD (p < 0.05).
3.1.2 Densidad
El aumento de CO2 produce un ligero descenso de la densidad, con diferencias significativas entre la muestra sin tratar o el tratamiento al 10% CO2 con las muestras tratadas tanto a 40 como a 70% CO2 (Tabla 1). Estos resultados difieren a los encontrados en la bibliografía. Cuando se aplicó este tratamiento a zumos de fresa y de naranja no se observaron diferencias en los azúcares fermentables con respecto al control [20, 22]. En el presente trabajo la disminución de la densidad podría deberse a la parcial solubilización de los lípidos de la membrana celular [23] o a la presencia de CO2 residual en el mosto tras el tratamiento.
3.1.3 Color
Tal y como se observa en la Tabla 2, los parámetros colorimétricos evaluados se modificaron con el tratamiento con CO2 supercrítico. Al aumentar el porcentaje de CO2, el mosto mantiene su tonalidad verdosa (a* constante) pero se vuelve más oscuro (L* disminuye), aunque sin diferencias significativas en ambos parámetros. Por el contrario, si se observan diferencias significativas en las tonalidades amarillas, ya que en el mosto tratado tanto a 40 como a 70% se observa una disminución de estas tonalidades (b* disminuye) respecto al mosto sin tratar. Sin embargo, la intensidad colorante (Tabla 3) permanece casi constante con los diferentes tratamientos, sin mostrar ninguna diferencia significativa respecto al mosto sin tratar, aunque sí entre las muestras tratadas a 40 y 70% CO2. No obstante, estas variaciones pueden considerarse despreciables para este parámetro. En cuanto a la tonalidad no se observan diferencias significativas, aunque presente una disminución de unas 0.50 unidades máximas entre el mosto sin tratar y el tratado al 70%. Estos resultados podrían estar relacionados con los cambios observados en los tres parámetros colorimétricos, que son mucho más evidentes a medida que aumenta el %CO2.
Para determinar si entre las muestras había diferencias de color perceptible, se determinó el valor de ∆E*. De esta forma, no hay diferencias perceptibles si tiene un valor entre 0 y 0.5, ligeramente perceptibles entre 0.5 y 1.5, perceptible entre 1.5 y 3.0, muy visible entre 3.0 y 6.0, y grandes diferencias entre 6.0 y 12.0 [24]. Tal y como se pone de manifiesto en la Tabla 4, se puede decir que a medida que se aumenta el porcentaje de CO2, la diferencia se va haciendo más notable, observándose únicamente una diferencia ligeramente perceptible entre la muestra control y las muestras tratadas al 70%, así como entre aquellas con mayor porcentaje de CO2.
Parámetros colorimétricos L*, a*, b* del espacio de color CIELAB. Letras diferentes en la misma columna denotan diferencias significativas según la prueba de LSD (p < 0.05).
Parámetros colorimétricos intensidad colorante (IC), tonalidad (T) y color aproximado. Letras diferentes en la misma columna denotan diferencias significativas según la prueba de LSD (p < 0.05).
Parámetro ∆E* calculado para todas las relaciones posibles entre el mosto tratado y sin tratar en las distintas condiciones de estudio.
3.2 Índice de polifenoles totales (IPT) y capacidad antioxidante
Los compuestos fenólicos protegen a los componentes celulares contra el daño oxidativo, por lo que es interesante estudiar en conjunto ambas variables respuesta a las diferentes condiciones del tratamiento. Como se puede observar en la Fig. 2, las muestras tratadas presentan un valor de IPT similares al de los mostos sin tratar, con una diferencia máxima de 0.35 unidades en el mosto tratado con scCO2 al 10%. Sin embargo, estos leves aumentos no son estadísticamente significativos (p < 0.05).
Estos resultados son similares a los obtenidos en otros estudios donde se aplicó el tratamiento de alta presión con CO2 supercrítico a otros zumos de fruta. Así, por ejemplo, no se observaron diferencias en el valor de IPT cuando se trató zumo de manzana a 100, 150, y 200 bar, 35 °C durante 10 min y un 67% de CO2 [25]. Sin embargo, en la bibliografía también aparece descrito el aumento del índice de polifenoles totales de zumos de frutas y verduras tras su procesado mediante tecnologías emergentes como tratamientos que aplican altas presiones hidrostáticas, ultrasonidos o campos eléctricos pulsados [26, 27]. Esto puede explicarse con la ruptura de la pared celular en las condiciones empleadas, consiguiendo la liberación de estos polifenoles al medio acuoso.
Si relacionamos los resultados obtenidos en los valores de IPT respecto de la capacidad antioxidante (Fig. 3), se observan resultados similares, ya que las diferencias obtenidas no fueron significativas entre las distintas condiciones de tratamiento, indicando que el tratamiento con CO2 supercrítico no modifica la capacidad antioxidante de los mostos. Cuando un zumo de manzana fue tratado a una presión comprendida entre 100 y 200 bar, a 35-45 ºC, con 60 % CO2 y con agitación de 200-600 rpm, no se obtuvieron modificaciones del valor de IPT [13]. Sin embargo, si se observó un leve aumento en la capacidad antioxidante tras el tratamiento, pero sin diferencias significativas. Similares resultados fueron observados por Liu et al. [28], obteniendo leves aumentos de la capacidad antioxidante de los zumos de lichi tratados a 80 bar 36 ºC y 80% CO2 durante 2 min aplicado sobre al zumo de lichi, sin modificarse el valor de IPT. Al tratar zumo de manzana a 100, 150, y 200 bar a 35 °C durante 10 min y un 67% de CO2, no se observó variación ni del IPT ni de la capacidad antioxidante [25].
 |
Figura 2 Índice de polifenoles totales del mosto sin tratar y tras el tratamiento utilizando diferentes concentraciones de CO2. |
 |
Figura 3 Capacidad antioxidante del mosto sin tratar y tras el tratamiento utilizando diferentes concentraciones de CO2. |
3.3 Inactivación de enzimas oxidativas
Los mostos y zumos de fruta sufren un fenómeno de pardeamiento por la acción de enzimas del grupo de las oxidorreductasas, como es la polifenol oxidasa (PPO).
En la Tabla 5 se pone de manifiesto como la actividad residual de la PPO con el tratamiento con scCO2 es inferior a la determinada tras la aplicación de SO2 a las dos concentraciones de estudio, lo que señala a esta técnica como una buena alternativa para el control de la oxidación en mostos blancos. Si comparamos entre las distintas condiciones de tratamiento, la inactivación más importante se observa para el mosto tratado al 40%, disminuyendo la actividad residual hasta casi un 45%, aunque sin diferencias significativas entre los tratamientos. Al comparar los tratamientos realizados a 40 y 70%, parece que el empleo de un mayor porcentaje no afecta significativamente a la AR de la PPO. En el estudio realizado por del Pozo-Insfran et al (2007), se obtuvo una menor actividad residual de la enzima PPO en mostos de uva moscatel, al emplear 7,5% de CO2 en lugar del 15 % [29].
En el estudio llevado a cabo por Illera et al. [13], en el que se trató zumo de manzana a un porcentaje constate de CO2 del 67%, a 100-200 bar y 35-45 ºC durante un máximo de 120 min, se observó que las presiones más elevadas inducían a tasas de inactivación de la enzima más rápidas, pero independientemente del tratamiento, siempre se llegaba a la misma actividad residual, que se encontraba en torno al 6%. Estos resultados justifican que se empleen presiones más bajas de tratamiento, como las que se han empleado en este trabajo. A pesar de que no se conoce exactamente el mecanismo de inactivación enzimática, el efecto del tratamiento podría explicarse con el aumento de la difusividad del CO2, perturbando el centro catalítico y provocando cambios estructurales y la inactivación de las enzimas [30].
Actividad residual de la polifenol oxidasa después del tratamiento con CO2. Letras diferentes en la misma columna denotan diferencias significativas según la prueba de LSD (p < 0.05).
3.4 Inactivación microbiológica
En la bibliografía se recogen estudios que ponen de manifiesto como el tratamiento con fluidos supercríticos produce una inactivación microbiana. Sin embargo, los mecanismos de inactivación microbiológica del CO2 aún no están del todo claros. Una de las posibles razones más relevantes que producen este efecto podría ser la extracción de componentes celulares vitales y los cambios estructurales que ocurren en la membrana celular [31]. Por su carácter lipofílico, el CO2 supercrítico difunde fácilmente por la bicapa lipídica de los microorganismos, pudiendo entrar al interior de la célula o acumularse en la membrana plasmática, afectando su permeabilidad y extrayendo componentes vitales de las mismas, como compuestos hidrofóbicos, alterando la estructura y/o el equilibrio de los nutrientes [32]. En el estudio llevado a cabo por Li et al., [33], tras el tratamiento con fluidos supercríticos, se observó en las imágenes obtenidas del microscopio electrónico de transmisión una dispersión asimétrica del citoplasma de la levadura Rhodotorula mucilaginosa, así como zonas vacías. Esta técnica también ha demostrado afectar a la integridad celular del hongo oleaginoso Mortierella alpina [34].
En este trabajo se observa un efecto esterilizante del mosto a medida que aumenta el %CO2, determinándose una concentración microbiana significativamente más baja al 70% en todos los casos (Tabla 6). Las levaduras parecen ser más sensibles al tratamiento que las bacterias lácticas, ya que se observa mayor reducción poblacional en el medio YPD que en el medio MRS. Este efecto es más notable al aplicar el 40%, reduciéndose las levaduras cerca del 95%, mientras que las bacterias lácticas sólo el 84%. Por tanto, se trata de una tecnología prometedora para el tratamiento contra algunas levaduras alterantes de mostos y vinos como las del género Brettanomyces spp., que desarrollan sabores y aromas anómalos, como a piel, animal, cuadra, medicamento, etc [36].
Los resultados observados son similares a los reportados en la bibliografía. Spilimbergo et al. [10] realizaron un análisis similar tras el tratamiento de zumo de melocotón y kiwi a 100 bar, 35 ºC, 300 rpm de agitación y 65% CO2, variando los tiempos de tratamiento entre 1 y 15 min. Observaron un paulatino descenso en las poblaciones microbianas de 1 a 10 min, logrando entorno al 30% de inactivación. Sin embargo, a mayores tiempos de proceso, concretamente entre 10 y 15 min, el efecto del tratamiento fue mucho mayor, alcanzándose finalmente un 90% de inactivación, lo que concuerda con los resultados encontrados en este estudio. Del mismo modo, Gasperi et al. 2009 alcanzaron una inactivación microbiológica total del zumo de manzana tratado a 100 bar, 36 ºC, 76% CO2, 300 rpm agitación a los 10 min de tratamiento [35].
Unidades formadoras de colonia por mililitro (UFC/mL) de aerobios totales, levaduras y bacterias lácticas, antes y después del tratamiento supercrítico. Letras diferentes en la misma columna denotan diferencias significativas según la prueba de LSD (p < 0.05).
4 Conclusiones
El tratamiento con CO2 supercrítico ha demostrado ser una tecnología prometedora para la estabilización enzimática y microbiana de mostos de uva blanca. No se observaron grandes diferencias en los parámetros fisicoquímicos entre el mosto sin tratar y el mosto tratado al 10% scCO2, aunque sí había ligeras diferencias respecto a los tratamientos al 40 y 70%. Del mismo modo, el índice de polifenoles totales y la capacidad antioxidante de los mostos tratados no se diferenciaron de forma significativa con respecto al control. Sin embargo, el tratamiento redujo la actividad residual de la PPO, obteniéndose los mejores resultados al aplicar 40% de CO2. Desde el punto de vista microbiológico, se presenta como una alternativa viable y de gran potencial para la esterilización no térmica de zumos, ya que se logra reducir la población inicial entre el 80 y 90%, consiguiendo la eliminación tanto de levaduras como de bacterias lácticas, así como aerobios totales. A la vista de los resultados obtenidos, parece que el 40% es el porcentaje de CO2 más apropiado para conseguir una buena conservación del mosto sin modificar de forma significativa las características físico-químicas del mosto.
References
- S.C. Morgan, M. Tantikachornkiat, C.M. Scholl, N.L. Benson, M.A. Cliff, D.M. Durall. The effect of sulfur dioxide addition at crush on the fungal and bacterial communities and the sensory attributes of Pinot gris wines. Int. J. Food Microbiol. 290, 1–14 (2019) [CrossRef] [Google Scholar]
- P. Ribéreau-Gayon, Y. Glories, A. Maujean, D. Dubourdieu. Handbook of Enology —The Chemistry of Wine Stabilization and Treatments (2nd edition, Vol. 2). John Wiley & Sons (2006) [CrossRef] [Google Scholar]
- P.C. Tsai, L.D. Araujo, B. Tian. Varietal aromas of Sauvignon Blanc: impact of oxidation and antioxidants used in winemaking. Fermentation 8, 686 (2022) [CrossRef] [Google Scholar]
- EFSA Panel on Dietetic Products, Nutrition and Allergies (NDA). Scientific Opinion on the evaluation of allergenic foods and food ingredients for labelling purposes 12(3894), 286 (2014) [Google Scholar]
- S. Giacosa, S.R. Segade, E. Cagnasso, A. Caudana, L. Rolle, V. Gerbi, SO2 in wines: Rational use and possible alternatives. In Red wine technology Academic Press 309–321 (2019) [CrossRef] [Google Scholar]
- R. Ferrer-Gallego, M. Puxeu, E. Nart, L. Martín, I. Andorrà. Evaluation of Tempranillo and Albariño SO2-free wines produced by different chemical alternatives and winemaking procedures. Food Res. Int. 102, 647–657 (2017) [CrossRef] [Google Scholar]
- A. Vernhet. Red wine clarification and stabilization. In Red wine technology. Academic Press 237–251 (2019) [CrossRef] [Google Scholar]
- G. Vignali, M. Gozzi, M. Pelacci, R. Stefanini. Non-conventional stabilization for fruit and vegetable juices: overview, technological constraints, and energy cost comparison. Food Bioproc. Tech. 15, 1729–1747 (2022) [CrossRef] [Google Scholar]
- F.M. Bertolini, G. Morbiato, P. Facco, K. Marszałek, E. Pérez-Esteve, J.L. Benedito, S. Spilimbergo. Optimization of the supercritical CO2 pasteurization process for the preservation of high nutritional value of pomegranate juice. J. Supercrit. Fluids 164, 104914 (2020) [CrossRef] [Google Scholar]
- S. Spilimbergo, L. Ciola. Supercritical CO2 and N2O pasteurisation of peach and kiwi juice. Int. J. Food Sci. Technol. 45(8), 1619–1625 (2010) [CrossRef] [Google Scholar]
- G.V. Amaral, E.K. Silva, R.N. Cavalcanti, C.P. Martins, L.G.Z. Andrade, J. Moraes, V.O. Alvarenga, J.T. Guimarães, E.A. Esmerino, M.Q. Freitas, M.C. Silva, R.S.L. Raices, A.S. Sant'Ana, M.A.A. Meireles, A. Cruz. Whey-grape juice drink processed by supercritical carbon dioxide technology: Physicochemical characteristics, bioactive compounds and volatile profile. Food Chem. 239, 697–703 (2018) [CrossRef] [Google Scholar]
- S. Fabroni, M. Amenta, N. Timpanaro, P. Rapisarda. Supercritical carbon dioxide-treated blood orange juice as a new product in the fresh fruit juice market. Innov. Food Sci. Emerg. Technol. 11(3), 477–484 (2010) [CrossRef] [Google Scholar]
- A.E. Illera, M.T. Sanz, S. Beltrán, R. Melgosa, A.G. Solaesa, M.O. Ruiz, Evaluation of HPCD batch treatments on enzyme inactivation kinetics and selected quality characteristics of cloudy juice from Golden delicious apples. J. Food Eng. 221, 141–150 (2018) [CrossRef] [Google Scholar]
- N. Smigic, I. Djekic, N. Tomic, B. Udovicki, A. Rajkovic. The potential of foods treated with supercritical carbon dioxide (sc-CO2) as novel foods. Br. Food J. 121(3), 815–834 (2019) [CrossRef] [Google Scholar]
- Q. Zhang, H. Zheng, J. Lin, G. Nie, X. Fan, J.F. García-Martín, The state-of-the-art research of the application of ultrasound to winemaking: A critical review. Ultrason. Sonochem. 95, 106384 (2023) [CrossRef] [Google Scholar]
- C. Delso, A. Berzosa, J. Sanz, I. Álvarez, J. Raso. Pulsed electric field processing as an alternative to sulfites (SO2) for controlling Saccharomyces cerevisiae involved in the fermentation of Chardonnay white wine. Food Res. Int. 165, 112525 (2023) [CrossRef] [Google Scholar]
- C. Cejudo, L. Casas, C. Mantel, E. Martínez de la Ossa. Supercritical impregnation of food packaging films to provide antioxidant properties. J. Supercrit. Fluids 128, 200–207 (2017) [CrossRef] [Google Scholar]
- I. Loira, A. Morata, M.A. Bañuelos, A. Puig-Pujol, B. Guamis, C. González, J.A. SuárezLepe. Use of Ultra-High Pressure Homogenization processing in winemaking: Control of microbial populations in grape musts and effects in sensory quality. Innov. Food Sci. Emerg. Technol. 50, 50–56 (2018) [CrossRef] [Google Scholar]
- S. Damar, M.O. Balaban. Review of dense phase CO2 technology: microbial and enzyme inactivation, and effects on food quality. J. Food Sci. 71(1), R1–R11 (2006) [CrossRef] [Google Scholar]
- H. Briongos, A.E. Illera, M.T. Sanz, R. Melgosa, S. Beltrán, A.G. Solaesa. Effect of high pressure carbon dioxide processing on pectin methylesterase activity and other orange juice properties. LWT - Food Sci. Technol. 74, 411–419 (2016) [CrossRef] [Google Scholar]
- M. Guo, J. Wu, Y. Xu, G. Xiao, M. Zhang, Y. Chen. Effects on microbial inactivation and quality attributes in frozen lychee juice treated by supercritical carbon dioxide. Eur. Food Res. Technol. 232(5), 803–811 (2011) [CrossRef] [Google Scholar]
- K. Marszałek, S. Skąpska, L. Woźniak, B. Sokołowska. Application of supercritical carbon dioxide for the preservation of strawberry juice: Microbial and physicochemical quality, enzymatic activity and the degradation kinetics of anthocyanins during storage. Innov. Food Sci. Emerg. Technol. 32, 101–109 (2015) [CrossRef] [Google Scholar]
- M.K. Oulé, K. Tano, A.-M. Bernier, J. Arul. Escherichia coli inactivation mechanism by pressurized CO2. Can. J. Microbiol. 52, 1208–1217 (2006) [CrossRef] [PubMed] [Google Scholar]
- H.G. Yuk, F. Sampedro, X. Fan, D.J. Geveke. Nonthermal processing of orange juice using a pilot‐plant scale supercritical carbon dioxide system with a gas–liquid metal contactor. J. Food Process. Preserv., 38(1) 630–638 (2014) [CrossRef] [Google Scholar]
- E.K. Silva, H.S. Arruda, M.N. Eberlin, G. Pastore, M.A.A. Meireles Effects of supercritical carbon dioxide and thermal treatment on the inulin chemical stability and functional properties of prebiotic-enriched apple juice. Food Res. Int. 125, 108561 (2019) [CrossRef] [Google Scholar]
- F.J. Barba, L.R. Mariutti, N. Bragagnolo, A.Z. Mercadante, G.V. Barbosa-Canovas, V. Orlien. Bioaccessibility of bioactive compounds from fruits and vegetables after thermal and nonthermal processing. Trends Food Sci. Technol. 67, 195–206 (2017) [CrossRef] [Google Scholar]
- W.F. Gomes, B.K. Tiwari, O. Rodriguez, E.S. de Brito, F.A.N. Fernandes, S. Rodrigues. Effect of ultrasound followed by high pressure processing on prebiotic cranberry juice. Food chem. 218, 261–268 (2017) [CrossRef] [Google Scholar]
- L. Liu, Q. Zeng, R. Zhang, Z. Wei, Y. Deng, Y. Zhang, X. Tang, M. Zhang. Comparative study on phenolic profiles and antioxidant activity of litchi juice treated by high pressure carbon dioxide and thermal processing. Food Sci. Technol. Res 21(1), 41–49 (2015) [CrossRef] [Google Scholar]
- D. del Pozo-Insfran, M.O. Balaban, S.T. Talcott. Inactivation of polyphenol oxidase in muscadine grape juice by dense phase-CO2 processing. Food Res. Int. 40(7), 894–899 (2007) [CrossRef] [Google Scholar]
- A. Murtaza, A. Iqbal, Z. Linhu, Y. Liu, X. Xu, S. Pan, W. Hu. Effect of highpressure carbon dioxide on the aggregation and conformational changes of polyphenol oxidase from apple (Malus domestica) juice. Innov. Food Sci. Emerg. Technol. 54, 43–50 (2019) [CrossRef] [Google Scholar]
- G.V. Amaral, E.K. Silva, R.N. Cavalcanti, L.P. Cappato, J.T. Guimaraes, V.O. Alvarenga, E.A. Esmerino, J.B. Portela, A.S. Sant’Ana, M.Q. Freitas, M.C. Silva, R.S.L. Raices, M.A.A. Meireles, A.G. Cruz. Dairy processing using supercritical carbon dioxide technology: Theoretical fundamentals, quality and safety aspects. Trends Food Sci. Technol. 64, 94–101 (2017) [CrossRef] [Google Scholar]
- S.R. Kim, M.S. Rhee, B.C. Kim, H. Lee, K.H. Kim. Modeling of the inactivation of Salmonella typhimurium by supercritical carbon dioxide in physiological saline and phosphate-buffered saline. J Microbiol. Methods. 70, 132–141 (2007) [CrossRef] [Google Scholar]
- J. Li, A. Wang, F. Zhu, R. Xu, X. Song Hu. Membrane Damage Induced by Supercritical Carbon Dioxide in Rhodotorula mucilaginosa. Indian J. Microbiol. 53(3), 352–358 (2013) [CrossRef] [PubMed] [Google Scholar]
- C.C. Ong, Y.-H. Chen. Investigation on cell disruption techniques and supercritical carbon dioxide extraction of Mortierella alpina lipid. Foods 11(4), 582 (2022) [CrossRef] [PubMed] [Google Scholar]
- F. Gasperi, E. Aprea, F. Biasioli, S. Carlin, I. Endrizzi, G. Pirretti, S. Spilimbergo. Effects of supercritical CO2 and N2O pasteurisation on the quality of fresh apple juice. Food chem. 115(1), 129–136 (2009) [CrossRef] [Google Scholar]
- A. Romano, M.C. Perello, A. Lonvaud-Funel, G. Sicard, G. de Revel. Sensory and analytical re-evaluation of “Brett character”. Food Chem. 114, 15–19 (2009) [CrossRef] [Google Scholar]
All Tables
Valores de pH, acidez y densidad del mosto sin tratar y tras la aplicación del tratamiento. Letras diferentes en la misma columna denotan diferencias significativas según la prueba de LSD (p < 0.05).
Parámetros colorimétricos L*, a*, b* del espacio de color CIELAB. Letras diferentes en la misma columna denotan diferencias significativas según la prueba de LSD (p < 0.05).
Parámetros colorimétricos intensidad colorante (IC), tonalidad (T) y color aproximado. Letras diferentes en la misma columna denotan diferencias significativas según la prueba de LSD (p < 0.05).
Parámetro ∆E* calculado para todas las relaciones posibles entre el mosto tratado y sin tratar en las distintas condiciones de estudio.
Actividad residual de la polifenol oxidasa después del tratamiento con CO2. Letras diferentes en la misma columna denotan diferencias significativas según la prueba de LSD (p < 0.05).
Unidades formadoras de colonia por mililitro (UFC/mL) de aerobios totales, levaduras y bacterias lácticas, antes y después del tratamiento supercrítico. Letras diferentes en la misma columna denotan diferencias significativas según la prueba de LSD (p < 0.05).
All Figures
 |
Figura 1 Diagrama de la planta de tratamiento con scCO2 supercrítico. |
| In the text | |
 |
Figura 2 Índice de polifenoles totales del mosto sin tratar y tras el tratamiento utilizando diferentes concentraciones de CO2. |
| In the text | |
 |
Figura 3 Capacidad antioxidante del mosto sin tratar y tras el tratamiento utilizando diferentes concentraciones de CO2. |
| In the text | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.