| Issue |
BIO Web Conf.
Volume 68, 2023
44th World Congress of Vine and Wine
|
|
|---|---|---|
| Article Number | 02026 | |
| Number of page(s) | 6 | |
| Section | Oenology | |
| DOI | https://doi.org/10.1051/bioconf/20236802026 | |
| Published online | 06 December 2023 | |
Análisis metabolómica del zumo de uva brasileño mediante resonancia magnética nuclear de hidrógeno
Metabolomic analysis of brazilian grape juices by 1H-nuclear magnetic resonance
1 University of Caxias do Sul, Rua Francisco Getúlio Vargas, 1130, 95070-560, Caxias do Sul, RS, Brazil
2 Oenological Reference Laboratory, Avenida da Vindima, 1855, 95084-470, Caxias do Sul, RS, Brazil
La determinación de las propiedades químicas del zumo de uva es una forma de promover la difusión y valorización de este producto, considerando su importancia socioeconómica para los países que lo producen, siendo buscado como fuente de alimentación natural a nivel mundial. En este sentido, la Resonancia Magnética Nuclear (RMN) permite la identificación de compuestos, generando un perfil metabólico, y se ha aplicado para probar autenticidad, origen geográfico y añada. En ese contexto, este estudio buscó identificar patrones de similaridad entre zumos de uva producidos en el estado de Rio Grande do Sul/Brasil, utilizando 1H RMN y quimiometría. Se analizaron 42 muestras, preparadas diluyendo 20 μL de muestra en 580 μL de agua deuterada (D2O) y, posteriormente, se realizó el análisis 1H RMN. A partir de los espectros obtenidos se identificaron ácidos málico, tartárico y cítrico, alanina, además de α y β glucosa y fructosa. Además, la intensidad de las señales referentes al etanol y al ácido acético podría estar relacionada con la fermentación de las muestras. Por lo tanto, se aplicó el análisis quimiométrico Análisis por Componentes Principales (ACP) para ayudar a crear un estándar para separar y clasificar las muestras por región y cosecha. En resumen, esta es la primera investigación que informa patrones de metabolitos de zumos de uva de la región de la Serra Gaúcha, que es la mayor productora de la viña y el vino de Brasil. Esto puede aplicarse para la denominación de origen y/o identificación de fraudes en este producto.
Abstract
The determination of the chemical properties of grape juice is a way to promote the dissemination and appreciation of this product, considering its socioeconomic importance for the countries that produce it, being sought as a source of natural food worldwide. In this sense, the Nuclear Magnetic Resonance (NMR) allows the identification of compounds, generating a metabolic profile, and it has been applied to prove authenticity, geographical origin and vintage. In this context, this work sought to identify patterns of similarity between grape juices produced in the state of Rio Grande do Sul/Brazil, using 1H NMR and chemometrics. In the 42 samples analysed were identified malic, tartaric and citric acids, alanine, in addition to α and β glucose and fructose. Furthermore, the intensity of the signals referring to ethanol and acetic acid could be related to the fermentation of the samples. Thus, the PCA chemometric analysis was applied to help create a standard for separating and classifying samples by region and harvest. In summary, this is the first work that reports patterns of metabolites of grape juices from the Serra Gaúcha region, which is the largest vine and wine producer in Brazil.
© The Authors, published by EDP Sciences, 2023
 This is an Open Access article distributed under the terms of the Creative Commons Attribution License 4.0, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
This is an Open Access article distributed under the terms of the Creative Commons Attribution License 4.0, which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
1 Introducción
Con un área de 46.912 hectáreas de viñas plantadas en Rio Grande do Sul (Brasil) en 2023, de acuerdo con los datos obtenidos del Instituto Brasileño de Geografía y Estadísticas (IBGE, en la sigla en portugués) el estado representa casi 60% del total de la área de viñedos de Brasil [1].
El zumo de uva es una bebida no fermentada elaborada con uvas sanas, frescas y maduras. La producción del zumo de uva ha aumentado de forma significativa en los últimos años. De esta forma, la producción del estado en el año de 2022 fue 35 millones de litros [2]. El aumento del consumo d’este producto está relacionado con las características nutricionales que lo colocan como una fuente saludable de alimentación [3].
Considerando la importancia económica para la región, el estudio de la determinación de la identidad química del zumo de uva está en apego con la apreciación de este producto a nivel internacional. Eso puede ser desarrollado por resonancia magnética nuclear (NMR, en inglés) permitiendo una identificación y cuantificación dirigida y no dirigida de compuestos y su capacidad discriminante que permitan generar un perfil metabolómico [4].
Los métodos basados en RMN combinados con análisis quimiométricas son reconocidos como herramientas analíticas versátiles para el conocimiento del control de calidad de alimentos y bebidas, y tiene la ventaja de detectar simultáneamente todos los compuestos en un único experimento simple de RMN, directamente de la muestra.
Ha sido aplicado como prueba de autenticidad, origen geográfico, variedades, cosecha y sistema de viticultura [5]. Para análisis como ese, el núcleo más utilizado es el hidrógeno (1H-RMN), principalmente por su abundancia natural que lleva a una mayor sensibilidad [6].
Así, el objetivo de este estudio fue obtener un perfil metabólico de distintos zumos de uva producidos en el estado de Rio Grande do Sul (Brasil), por 1H-RMN, además de aplicar los resultados para diferenciar en los mismos en regiones, cosechas y variedades distintas.
2 Materiales y métodos
2.1 Muestras de zumo de uva
Para este estudio, fueron analizadosun total de 42 zumos de uva tintos y blancos producidos en el estado de Rio Grande do Sul (Brasil), de las cosechas 2019 hasta 2022, incluyendo zumos varietales y cortados de cultivares de uva Vitis labrusca e híbridas, como se reporta en la Tabla 1.
Lista de muestras.
2.2 Análisis RMN
El método OIV-MA-AS316-01 se utilizó con modificaciones [7]. Así alícuotas de 20µL de muestra fueron añadidas a 580µL de agua deuterada (D2O) directamente en tubos de RMN. El espectro 1H-RMN de los zumos de uva fue adquirido a 303K en un espectrómetro Fourier 300 Bruker 7,05 Tesla, observando 1H a 300,13MHz, equipado con una sonda de resonancia BBI (de doble resonancia con amplio espectro en canal X y detección indirecta).. Buscando una mejor resolución de las señales de los compuestos presentes en la muestra, la supresión de la señal del agua residual fue verificada utilizando una secuencia pulso ZGPR. Sesenta y cuatro transientes fueron llevados a cabo para acumular señales con intensidades suficientes para incrementar el reporte señal/ruido. Para la colecta y procesamiento de los datos, el software TopSpin fue usado.
El análisis de los componentes principales fue realizado utilizando el software Bruker AMIX. Los límites de los espectros fueron estimados entre 0,05 y 10,00 ppm con 0,04 ppm en ancho de frecuencia 1H. El área alrededor del agua no deuterada, 4,69 ppm, fue excluída del proceso de selección de frecuencias. Los datos fueron tratados utilizando la distribución rectangular normal con un nivel de confianza de 99%.
3 Resultados y Discusiones
3.1. Identificación de las senãles 1H-RMN
En el espectro de RMN de 1H, muchos picos fueron observados, que se dividieron en regiones. En la primera, variando de 0,5 hasta 3,0 ppm, donde pueden ser observados los ácidos orgánicos, los aminoácidos y el etanol. En la segunda región, entre 3,0 y 6,0 ppm, están presentes principalmente los carbohidratos. La tercera región, entre 6,0 y 10,0 ppm, se observaron los compuestos aromáticos, principalmente fenólicos, de intensidad más baja, no visibles en este experimento.
En este sentido, la Figura 1 presenta las expansiones de los espectros de la muestra 21, entre 0,5 hasta 3,0 ppm (A) y entre 3,0 y 6,0 ppm (B), para que sean más visibles las señales.
Por medio de éste identificamos α y β glucosa y frutosa como los principales carbohidratos presentes, a través de dobletes a 5,14 ppm para α-glucosa y 4,55 ppm para β-glucosa. Estos son isómeros diferenciados por la posición relativa del grupo hidroxilo (OH), en relación a las posiciones axiales y ecuatoriales del mismo anillo - para α y ecuatorial para β, y a 4,02 ppm para la fructosa [8].
Aunque ocurre en otras plantas, el ácido tartárico es asociado a la uva porque está presente en grandes cantidades, cuando comparado a otros ácidos orgánicos de las uvas [9], este compuesto puede ser identificado por el singulete a 4,45 ppm. El ácido málico fue identificado por el doble de dobles (dd) en 2,75 y 2,80 ppm, mientras que el ácido cítrico fue identificado por el dd a 2,60 y 2,66 ppm.
Otros compuestos como la alanina, que representa 18% de los aminoácidos libres en el mosto [10], fue identificado por el dd a 1,39 ppm. Finalmente, se identificó la presencia del ácido acético por el singulete a 2,00 ppm, y del etanol, que comprende una señal triplete a 1,08 ppm.
Estos últimos son esenciales en la evaluación metabolómica de los zumos, pues poseen un papel fundamental en la verificación de la calidad del zumo, ya que la presencia y/o intensificación de estos compuestos indican un proceso de fermentación [11]. En la Figura 2, evaluamos la calidad del zumo almacenado durante un año, observamos un leve aumento de las señales de dichos compuestos, en comparación a zumos producidos a partir de una misma variedad de uva, de distintas cosechas, siendo más intensos para la cosecha 2021 en relación a la cosecha 2022.
 |
Figura 1 Compuestos identificados en el zumo de uva entre 0,5 y 3,0 ppm (A) 3,0 y 6,0 ppm (B). |
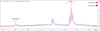 |
Figura 2 Comparación de las señales del etanol y del ácido acético para zumos de distintas cosechas. |
3.2 Análisis quimiométrico
El modelo ACP, inicialmente fue construído a partir de los datos de 1H-RMN de todas las muestras, con el objetivo de evaluar la región productora, donde los dos componentes principales, PC1 y PC2, explican juntos 86,39% de la varianza total, como puede ser observado en la Fig. 3.
La muestra 39 se destacó de las demás, siendo la única proveniente de la ciudad de Camaquã (Rio Grande do Sul), región sur del estado, la cual presenta los mayores índices de insolación durante el periodo de florecimiento hasta el punto de maduración, lo que influencia en la cantidad de azúcar y ácidos presentes en la uva.
La Muestra 42 fue elaborada a través de olla de extracción de zumos de uva elaborados a partir del tanque extractor se observó que ocurre una cierta incorporación de agua en el proceso, cerca de 16%, en comparación con el intercambiador de calor, disminuyendo la concentración de azúcar [12].
Las muestras 19 y 20 son las únicas de cultivares blancas, aquí separadas de las demás. Los zumos de uva tinta fueron producidos a partir de las variedades americanas e híbridas, donde las características genéticas pueden haber interferido en el análisis quimiométrico. Como la variedad BRS Rúbea fue desarrollada a partir del cruce de las variedades Niágara Rosada y “Bordô”, y la BRS Violeta fue obtenida a partir del cruce de la BRS Rúbea e IAC 1389-21 [13].
En otro test realizado, se evaluó la cosecha de los zumos producidos de una misma bodega, se analizaron 18 muestras, los componentes principales, PC1 y PC2, explican juntos 89,40% de la varianza total. Se observa en la Figura 4, que las muestras de la cosecha de 2022 están dispersas en los cuadrantes superiores y las muestras de la cosecha 2021 en los cuadrantes inferiores. Para la zafra de 2020, no fue posible reconocer un patrón.
El clima de Rio Grande do Sul presenta distintas condiciones climáticas para la vitivinicultura. Región de clima templado, que presenta veranos calientes e inviernos rigurosos, y precipitaciones equilibradas a lo largo del año [14].
Las cosechas de 2020 y 2022 presentaron niveles de precipitación más bajos a la media histórica durante el período de maduración y vendimia de las uvas. Durante ese período, una baja precipitación asociada a las altas temperaturas, ocasionan un estrés hídrico y térmico para la parra, aunque sea tolerante a altas temperaturas, cuando en exceso, interfiere en el metabolismo de la parra resultando en niveles más altos de azúcares y menor acidez [15,16].
La cosecha de 2021 presentó temperaturas amenas y precipitaciones superiores a la media, perjudicando principalmente las variedades de maduración intermedia, adelantándo la cosecha para evitar problemas de sanidad, disminuyendo así el potencial de maduración y la composición fenólica de las uvas [17].
 |
Figura 3 Resultado del ACP para las 42 muestras. |
 |
Figura 4 Resultado del ACP para la csosecha. |
4 Conclusiones
La RMN como herramienta analítica, con mínima preparación de muestra, permitió el análisis del perfil químico de los zumos. Fueron identificadas las moléculas de ácidos málico, tartárico, cítrico y acético, los cuales son característicos para describir la acidez de la uva.
Entre los carbohidratos identificados, la glucosa y la fructosa fueron encontradas en todas las muestras, también compuestos característicos de los zumos de uva. Se destaca la presencia del etanol, aunque considerada una bebida no-alcohólica, o con bajo grado alcohólico volumétrico, dicho metabolito puede estar presente en su composición.
Esta investigación ha mostrado que la espectroscopia de 1H-RMN combinada con la quimiometría puede ser una herramienta valiosa para el control de calidad de los zumos de uva.
Sin embargo, existe la necesidad de continuación principalmente en lo que se refiere al uso de nuevos métodos RMN para que sea posible su aplicación más allá de la identificación de fraudes, siendo posible aplicar los resultados para la denominación de origen de los zumos producidos en el estado.
References
- Instituto Brasileiro de Geografia e Estatística (IBGE), Levantamento Sistemático da Produção Agrícola (2023) [Google Scholar]
- Sistema de Cadatro Vinícola – Secretaria Estadual da Agricultura, Pecuária e Desenvolvimento Rural (2022) [Google Scholar]
- L.L.T. Toscano, A.S. Silva, A.C.L. França,; B.R.V. Sousa, E.J.B. Almeida Filho, M.S. Costa, A.C.T. Biasoto, D.F. Silva, K.F. Sena, G.S. Cerqueira, M.C.R Gonçalves, Eur J Nutr. 58, 2997 (2019) doi.org/10.1007/s00394-019-02139-6 [Google Scholar]
- G.A.B. Canuto, J.L. Costab, P.L.R. Cruza, A.R.L. Souza; A.T. Faccioa, A. Klassenc, K.T. Rodriguesa, M.F.M. Tavaresa, Quím. Nova 41, 75 (2017) doi.org/10.21577/0100-4042.20170134 [Google Scholar]
- D.A. Magdas, A. Pirnau, I. Feher, F. Guyon, B.I. Cozar, LWT-Food Sci Technol 109, 422 (2019) doi.org/10.1016/j.lwt.2019.04.054 [CrossRef] [Google Scholar]
- M.K.A.G. Tabago, M.N. Calingacion, J. GARCIA, Food Chem. 2, 100009 (2021) doi.org/10.1016/j.fochms.2020.100009 [Google Scholar]
- OIV-MA-AS316-01 “Quantitation of glucose, malic acid, acetic acid, fumaric acid; shikimic acid and sorbic acid in wine using quantitative nuclear magnetic resonance spectrometry (1H-NMR)” [Google Scholar]
- Y. Navarro, R. Soengas, M.J. Iglesias, F.L. Ortiz, J. Chem. Educ. 97, 831 (2020) doi.org/10.1021/acs.jchemed.9b00651 [CrossRef] [Google Scholar]
- Z. Ghasempour, M. Alizadeh-Khaledabad, M.R. Vardast, M. Rezazad-Bari, J. Anal. Chem. 73, 855 (2018) doi:10.1134/s1061934818090046 [CrossRef] [Google Scholar]
- S.V. Dutra, C.E. Daudt, M. Souza, Food Sci. Technol. 19, 179 (1999) doi.org/10.1590/S0101-20611999000200004 [CrossRef] [Google Scholar]
- C.W.P.S. Grandizoli, F.R. Campos, F. Simonelli, A. Barison, Quím. Nova 37, 1227 (2014) doi.org/10.5935/0100-4042.20140208 [Google Scholar]
- A.R. Marcon, Universidade de Caxias do Sul (2013) [Google Scholar]
- U.A. Camargo, J.D.G. Maia, J.C. Nachtigal, Embrapa Uva e Vinho, Comunicado Técnico 63 (2005) [Google Scholar]
- A.P. Cargnin, A.M.A. Bertê, S.B. Oliveira, B.O. Lemos, C.R. Silva, G.S. Ferreira, L.S. Mieres, J. Marcon, Atlas Socioeconômico do Rio Grande do Sul (SPGG, Porto Alegre, 2021) [Google Scholar]
- M.E.B. Alves, J. Tonietto, M.C. Zanus, Embrapa Uva e Vinho, Documentos 120 (2020) [Google Scholar]
- A.H. Junges, H.P. Santos, L.R. Garrido, G.E. Pereira, Embrapa Uva e Vinho (2022) [Google Scholar]
- A.H. Junges, H.P. Santos, G.E. Pereira, L.R. Garrido, Embrapa Uva e Vinho (2021) [Google Scholar]
Todas las tablas
Todas las figuras
 |
Figura 1 Compuestos identificados en el zumo de uva entre 0,5 y 3,0 ppm (A) 3,0 y 6,0 ppm (B). |
 |
Figura 2 Comparación de las señales del etanol y del ácido acético para zumos de distintas cosechas. |
 |
Figura 3 Resultado del ACP para las 42 muestras. |
 |
Figura 4 Resultado del ACP para la csosecha. |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.



